Bài giảng Hóa vô cơ A - Chương 2: Các nguyên tố phân nhóm IA - Nguyễn Văn Hòa
Lý tính
• Màu sắc: trắng bạc, có ánh kim rất mạnh.
• Rất mềm.
• Cấu trúc mạng: lập phương tâm khối.
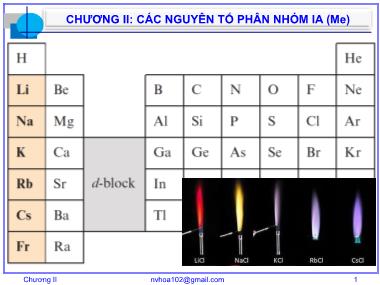
• Khi đốt kim loại hoặc hợp chất dễ bay hơi cho
ngọn lửa có màu đặc trưng.
• Dễ tan lẫn vào nhau và dễ tạo hỗn hóng với Hg,
hỗn hóng natri dùng làm chất khử mạnh.
• Tan trong amoniac lỏng.
Hóa tính
Tính khử mạnh, tăng dần từ Li đến Cs:
• Phản ứng với hydro
2Me + H
2 2MeH (muối rắn, bị thủy phân)
• Phản ứng với oxi
4Li + O
2 2Li2O
2Na + O
2 Na2O2 ( )
Me’ (K, Rb, Cs) + O2 Me’O2 ( )
(Rb, Cs tự bốc cháy)
Bạn đang xem tài liệu "Bài giảng Hóa vô cơ A - Chương 2: Các nguyên tố phân nhóm IA - Nguyễn Văn Hòa", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Bài giảng Hóa vô cơ A - Chương 2: Các nguyên tố phân nhóm IA - Nguyễn Văn Hòa
Chương II [email protected] 1 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) Chương II [email protected] 2 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) NỘI DUNG NHẬN XÉT CHUNG I. ĐƠN CHẤT 1. Lý tính 2. Hóa tính 3. Trạng thái tự nhiên, điều chế, ứng dụng II. HỢP CHẤT 1. Các oxit, peoxit, supeoxit, hydroxit 2. Các muối TÀI LIỆU [1] – Tập 2, Chương 2: trang 31 – 48 [2] – Chương 9: trang 202 – 210 [3] – Phần 1, Chương 2: trang 15 – 67 [4] – Chapter 11: page 326 – 347 Chương II [email protected] 3 NHẬN XÉT CHUNG • Cấu hình electron hóa trị của Me: ns1 Tính chất đơn giản nhất Thể hiện tính khử mạnh (KL điển hình) Me – e ion Me+ • Me2O, MeOH: bazơ mạnh (KL kiềm) • Các Me+: dễ tan • Li Cs: R , n , hiệu ứng chắn , hiệu ứng xâm nhập ⇒ Tính KL ; Tính bazơ của các Me2O, MeOH CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) Chương II [email protected] 4 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) I. ĐƠN CHẤT 1. Lý tính • Màu sắc: trắng bạc, có ánh kim rất mạnh. • Rất mềm. • Cấu trúc mạng: lập phương tâm khối. • Khi đốt kim loại hoặc hợp chất dễ bay hơi cho ngọn lửa có màu đặc trưng. • Dễ tan lẫn vào nhau và dễ tạo hỗn hóng với Hg, hỗn hóng natri dùng làm chất khử mạnh. • Tan trong amoniac lỏng. Chương II [email protected] 5 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) , -1.cm-1 I1, eV tnc,, 0C ts, 0C E 0 , V d, g/cm3 Li 11,8.104 5,39 180,5 1347 -3,04 0,53 Na 23,0.104 5,14 97,8 881 -2,71 0,97 K 15,9.104 4,34 63,2 766 -2,93 0,86 Rb 8,9.104 4,18 39,0 688 -2,98 1,53 Cs 5,6.104 3,89 28,5 705 -3,03 1,87 Bảng 2.1 Các đại lượng vật lý của các kim loại Me Chương II [email protected] 6 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) 2. Hóa tính Tính khử mạnh, tăng dần từ Li đến Cs: • Phản ứng với hydro 2Me + H2 2MeH (muối rắn, bị thủy phân) • Phản ứng với oxi 4Li + O2 2Li2O 2Na + O2 Na2O2 ( ) Me’ (K, Rb, Cs) + O2 Me’O2 ( ) (Rb, Cs tự bốc cháy) to Chương II [email protected] 7 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) • Phản ứng với halogen Me + ½(F2, Cl2) MeF, MeCl (tự bốc cháy khi có mặt hơi ẩm ở to thường) Me + ½Br2 lỏng MeBr (Li, Na chỉ phản ứng ở bề mặt; K, Rb, Cs gây nổ) Me + ½I2 MeI (chỉ phản ứng mạnh khi đun nóng) • Phản ứng với nước Me + H2O MeOH + ½H2 (Li– mạnh; Na– mãnh liệt; K– bốc cháy; Rb, Cs– nổ) Chương II [email protected] 8 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) 3. Trạng thái tự nhiên, điều chê ́: - Na, K phổ biến nhất trong nhóm IA: Nước biển, khoáng alumosilicat, muối kép (Kainit – KCl.MgSO4.3H2O; Carnalit – KCl.MgCl2.6H2O; Silvinit – KCl.NaCl) - Điều chê ́: • Li: điện phân nóng chảy LiCl + KCl KCl LiCl Chương II [email protected] 9 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) • Rb, Cs: 2RbCl + Ca → CaCl2 + 2Rb 7000C P chân không 6060C • Na: Điện phân nóng chảy NaCl hoặc NaOH • K: Dùng Fe khử KOH ở nhiệt độ cao: t0 cao P rất bé 4KOH + 3Fe Fe3O4 + 4K + 2H2 %mol: 60,5 NaCl – 22,5 KCl – 17 NaF Chương II [email protected] 10 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) II. HỢP CHẤT 1. Các oxit, peoxit, supeoxit, hydroxit • Các oxit – Me2O - Điều chế: Li + O2 Li2O Na + O2 Na2O2 Na2O2 + Na 2Na2O Me’ (K, Rb, Cs) + O2 Me’O2 Me’O2 + 3 Me’ 2 Me’2O - Tính chất: Me2O + H2O 2MeOH (phản ứng mạnh và tỏa nhiều nhiệt, trừ Li2O) Chương II [email protected] 11 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) • Các peoxit – Me2O2 - Bền nhiệt - Bị phân hủy trong nước ở tothấp hoặc axit H2O2 Na 2 O 2 + H 2 SO 4 Na 2 SO 4 + H 2 O 2 Na 2 O 2 + 2H 2 O 2NaOH + 2H 2 O 2 - Oxi hóa mạnh 2FeS2 + 15Na2O2 Fe2O3 + 4Na2SO4 + 11Na2O - Ứng dụng 2Na2O2 + 2CO2 2Na2CO3 + O2 2Na2O2 + H2O + CO2 Na2CO3 + H2O2 Chương II [email protected] 12 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) • Các supeoxit – MeO2 - Bền nhiệt - Bị phân hủy trong nước hoặc axit H2O2 + O2 KO 2 + H 2 SO 4 K 2 SO 4 + H 2 O 2 + O 2 KO 2 + 2H 2 O 2KOH + 2H 2 O 2 + O 2 - Oxi hóa mạnh 2KO2 + CO K2CO3 + O2 • Ozonit – KO3 4O3 + 6KOH 4KO3 + 2KOH.H2O + O2 Chương II [email protected] 13 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) • Các hydroxit – MeOH - Bazo mạnh, tăng dần từ LiOH đến CsOH - Bền nhiệt (trừ LiOH) - Hút ẩm mạnh - Tan nhiều trong nước và rượu, tỏa nhiệt mạnh. 2. Muối halogenua - Dễ tan (trừ LiF) - NaCl: muối ăn, điều chế Na, NaOH, Cl2, HCl, nước Javel - KCl: phân kali, điều chế KOH, KClO3 Chương II [email protected] 14 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) 3. Muối bicacbonat, cacbonat • Bicacbonat – MeHCO3 - Không bền nhiệt, ít tan trong nước. • Cacbonat – Me2CO3 (Na2CO3 - Soda): - Bền nhiệt, tan trong nước cho môi trường kiềm yếu. - Riêng Li2CO3 ít tan. - Ứng dụng: sản xuất xà phòng, thủy tinh, giấy, sợi - Điều chế soda theo phương pháp Solvay. Chương II [email protected] 15 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) Hình 2.1 Quy trình điều chế soda theo pp Solvay Chương II [email protected] 16 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) Chương II [email protected] 17 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) CÂU HỎI ÔN TẬP 1. Các kim loại kiềm có những đặc điểm chung gì? Giải thích tại sao? 2. Các tính chất vật lý đặc trưng của các kim loại kiềm và giải thích? 3. Tại sao kim loại kiềm có tính khử mạnh và tính khử tăng dần? Lấy các phản ứng minh họa. 4. Các phương pháp điều chế kim loại kiềm? 5. Nguyên tắc điều chế các Me2O và cho biết tính chất đặc trưng của chúng? Chương II [email protected] 18 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) CÂU HỎI ÔN TẬP 6. Peoxit đặc trưng cho pepoxit kim loại kiềm là gì? Nó có tính chất gì? 7. Cho biết những điểm giống nhau và khác nhau giữa supeoxit kim loại kiềm với peoxit và ozonit? 8. Các MeOH có độ tan, độ bền, độ bazo như thế nào? 9. Các muối đặc trưng của Me có độ tan, độ bền như thế nào? Cho biết ứng dụng của chúng? Chương II [email protected] 19 CHƯƠNG II: CÁC NGUYÊN TỐ PHÂN NHÓM IA (Me) CÂU HỎI CHUẨN BỊ BÀI MỚI 1. Các kim loại kiềm thổ (M) có những đặc điểm chung gì? 2. Tính chất vật lý và hóa học của M giống và khác Me như thế nào? Tại sao? 3. Các khoáng chất thường gặp của M? 4. Nguyên tắc điều chế M? 5. Các hợp chất của M có độ tan, độ bền, tính bazo [đối với M(OH)2] như thế nào? Chúng khác gì so với các hợp chất của Me.
File đính kèm:
 bai_giang_hoa_vo_co_a_chuong_2_cac_nguyen_to_phan_nhom_ia_ng.pdf
bai_giang_hoa_vo_co_a_chuong_2_cac_nguyen_to_phan_nhom_ia_ng.pdf

